1Corresponding author email: smarsilio@ucdavis.edu
Перевод: Файзуллина Р. Р., ветеринарный врач-онколог, Ветеринарная клиника доктора Сотникова, г. Санкт-Петербург
Окончание, начало в №3-4/2022
Хроническая энтеропатия – распространенное заболевание, особенно среди взрослых кошек. Было отмечено, что в последнее десятилетие процент заболевших животных увеличился.
Патология
Тонкоигольная аспирационная биопсия (ТИАБ)
ВЗК у кошек в основном характеризуется смешанным инфильтратом, состоящим из (зрелых) лимфоцитов и плазматических клеток. Воспаление обнаруживается в собственной пластинке, иногда распространяется на эпителий и обычно сопровождается архитектурными изменениями, такими как притупление ворсинок и деформация крипт. Мелкоклеточная лимфома характеризуется эпителиальной/слизистой ± трансмуральной инфильтрацией с хорошо дифференцированными лимфоцитами, нарушающими нормальную архитектуру и замещающими большую часть собственной пластинки. Однако при мелкоклеточной лимфоме часто наблюдаются сопутствующие воспалительные изменения в одной и той же и/или нескольких частях кишечного тракта19,31,54,55,56. Если принять во внимание гистологический состав ВЗК и мелкоклеточной лимфомы, становится очевидным, что для дифференциации этих двух заболеваний тонкоигольные аспираты, как правило, бесполезны. Они не имеют архитектуры ткани, достаточной для определения правильного диагноза, а наличие небольших зрелых лимфоцитов в любом количестве не позволяет делать какие-либо выводы, поскольку является отличительной чертой обоих процессов – ВЗК и МЛ. Однако тонкоигольные аспираты могут быть полезными для исключения других дифференциальных диагнозов, таких как крупноклеточная лимфома или грибковое заболевание у кошек с новообразованиями в брюшной полости, лимфаденопатией или гепато-/спленомегалией.Гистопатология
Несмотря на то что гистопатологическое исследование биоптатов остается золотым стандартом для диагностики хронической энтеропатии, оно связано с потенциальными «ловушками», которые следует учитывать при интерпретации заключений патологов. В одной публикации, посвященной изучению корреляции между пятью разными патологами, оценивающими степень клеточной инфильтрации в слизистой оболочке кишечника у собак и кошек, была отмечена очень высокая вариабельность результатов исследования74. Это послужило толчком к созданию Группы по стандартизации диагностики и лечения заболеваний желудочно-кишечного тракта в рамках Всемирной ассоциации ветеринарной медицины мелких домашних животных (WSAVA), чтобы стандартизировать гистопатологическую оценку биоптатов желудочно-кишечного тракта16,75. В итоге была опубликована стандартная форма для патологов, которая включала схему классификации клеточных инфильтратов, а также архитектурных изменений, таких как повреждение эпителия, притупление ворсинок, воспалительные изменения крипт, фиброз и расширение лимфатических протоков. Результаты оценивались по шкале от 0 (нормальный) до 3 (тяжелый)16,75. Однако дальнейшие исследования показали, что вариабельность гистологических результатов сохранялась, по этой причине другие авторы пытались упростить схему классификации34.Прочие затруднения, связанные с текущими рекомендациями WSAVA, касались демографических характеристик, которые послужили примерами для определения «нормального исходного значения». Эти пробы были собраны у группы преимущественно молодых (около 1,5 лет) кошек, свободных от специфических патогенов, однако данная группа вряд ли является репрезентативной для группы кошек с признаками хронической энтеропатии. В недавнем исследовании автора изучались гистопатологические данные эндоскопической биопсии желудка и двенадцатиперстной кишки у 20 здоровых кошек (принадлежащих клиентам клиники) с демографическими характеристиками, аналогичными характеристикам кошек с хронической энтеропатией (средний возраст – 9,5 лет, диапазон – от 3 до 18 лет)47. У всех животных были обнаружены гистопатологические данные, которые были признаны отклонением от нормы на основании текущих критериев WSAVA. Однако позже только у трех кошек развилось заболевание желудочно-кишечного тракта. У остальных 17 кошек клинические признаки так и не появились после среднего периода наблюдения, составлявшего 709 дней.
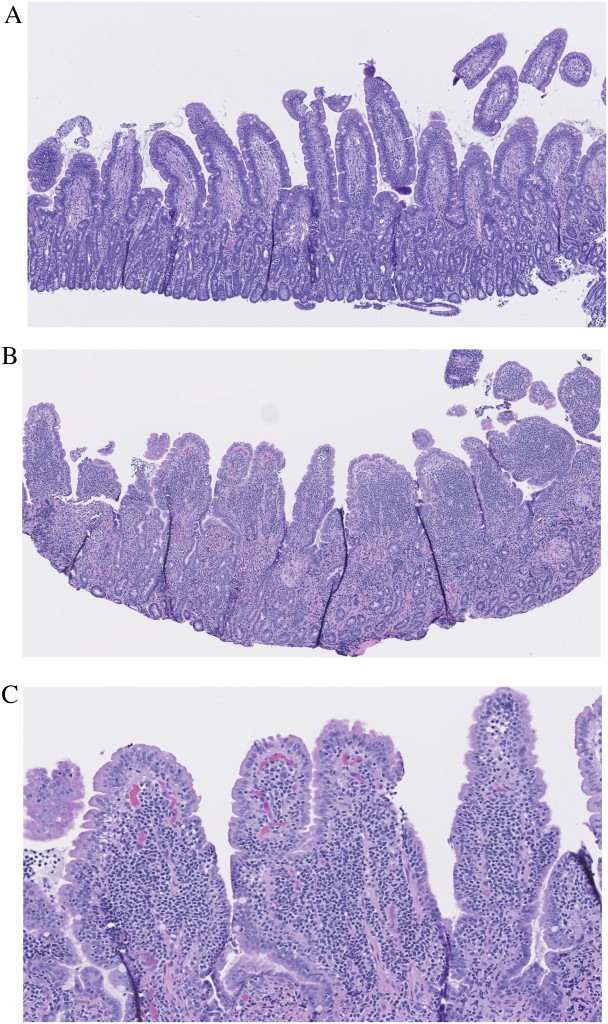
Несмотря на все недостатки, гистопатология среди доступных в настоящее время методов исследования по-прежнему остается наиболее надежной для диагностики хронической энтеропатии. Клиницисты должны обращать внимание на описание патологом архитектурных изменений, поскольку эти изменения были признаны WSAVA не менее важными при оценке хронических энтеропатий у кошек16,75. Наиболее частыми заболеваниями тонкого кишечника у кошек являются ВЗК и мелкоклеточная лимфома. В то время как ВЗК характеризуется наличием смешанного инфильтрата лимфоцитов и плазматических клеток, МЛ представляет собой мономорфную популяцию небольших зрелых лимфоцитов, инфильтрирующих и стирающих собственную пластинку и эпителий (при эпителиотропном типе лимфомы), а иногда и более глубокие слои: подслизистый и мышечный (при трансмуральных поражениях; рис. 4). Однако, как упоминалось выше, МЛ может иметь в составе воспалительный компонент, и поэтому неудивительно, что тяжелые случаи лимфоплазмоцитарного энтерита (ЛПЭ) иногда трудно отличить от ВЗК. Кроме того, давно бытуют подозрения по поводу имеющейся тенденции к прогрессированию ЛПЭ в МЛ. В подобных сомнительных случаях могут потребоваться дополнительные методы диагностики, такие как иммуногистохимия (ИГХ) и методы на основе ПЦР37,55.
A – мягкий ЛПЭ. Легкая задержка роста ворсинок и гиперплазия крипт. Незначительно повышенная инфильтрация лимфоцитами и плазматическими клетками.
B – эпителиотропная МЛ, 5-кратное увеличение. Мономорфная популяция маленьких зрелых лимфоцитов инфильтрирует и стирает собственную пластинку. Наблюдаются серьезные архитектурные изменения, включая задержку роста ворсинок, слияние ворсинок и фиброз. Собственная пластинка пронизана плотным инфильтратом мелких лимфоцитов.
C – 10-кратное увеличение изображения B. Инфильтрат присутствует преимущественно в собственной пластинке ворсинок, а также образует гнезда и бляшки в эпителии.
Стоит отметить, что диагноз ЛПЭ не эквивалентен диагнозу ВЗК. ЛПЭ может быть связан с паразитарными заболеваниями кишечника, пищевой гиперчувствительностью или даже гипертиреозом. Это объясняет необходимость исключения других дифференциальных диагнозов до проведения инвазивной диагностики, такой как биопсия кишечника30.
Несмотря на то что архитектурные изменения являются хорошим индикатором степени тяжести заболевания ЖКТ, клеточная инфильтрация по-прежнему имеет важное значение, поскольку позволяет предположить этиологию поражений. Выраженный эозинофильный воспалительный инфильтрат может быть связан с паразитами, пищевой гиперчувствительностью или Т-клеточной лимфомой6 либо возникать как часть гиперэозинофильного синдрома. Это системное эозинофильное заболевание характеризуется повышенной выработкой предшественников эозинофилов в костном мозге. У пациентов наблюдаются периферическая (зрелая) эозинофилия и эозинофильная инфильтрация во многих тканях (например, в желудочно-кишечном тракте, селезенке, печени, лимфатических узлах, сердце и легких) с последующим повреждением органов28,52,72. Нейтрофильная (гнойная) и/или гистиоцитарная инфильтрация может указывать на инфекционную причину и требует дополнительной диагностики, включая специальное окрашивание и другие тесты50,69.
Таким образом, клиницисты всегда должны интерпретировать гистопатологические результаты с учетом истории болезни пациента, а также данных, полученных при проведении других клинических исследований.
При ознакомлении с заключением морфолога клиницистам следует обратить особое внимание на описание архитектурных изменений. В тех случаях, когда изменения архитектуры ткани минимальные или отсутствуют, клеточная инфильтрация легкой степени не является основанием для постановки диагноза.
Дополнительное тестирование ХЭК
Даже при проведении адекватной биопсии в некоторых неоднозначных случаях требуется применение дополнительных тестов. Иммуногистохимия (ИГХ) и тесты на клональность в настоящее время считаются новейшим достижением для дифференциации ВЗК и МЛ. При неопластических поражениях лимфоциты происходят из одной (или нескольких) клеток-предшественников, и, таким образом, дочерние клетки имеют ту же рецепторную специфичность, то есть (олиго-) клональные перестройки рецепторов. При воспалительных процессах лимфоциты происходят из нескольких клеток-предшественников с различной антиген-рецепторной специфичностью, то есть перестройками поликлональных рецепторов. Воспалительные реакции обычно включают смесь Т-, В-лимфоцитов и других иммунных клеток. Данная концепция лежит в основе иммуногистохимического анализа и анализа на основе ПЦР.Иммуногистохимия – это первый шаг к дальнейшей дифференциации ВЗК и МЛ в неоднозначных случаях. Специфическое окрашивание включает CD3 для Т-клеток, CD20, CD79a или PAX-5 для В-клеток и других клеток. Окрашивание помогает определить, все ли лимфоциты, наблюдаемые при обычном окрашивании H&E, принадлежат к одной линии, или же инфильтрат состоит из смеси Т-клеток, В-клеток и плазматических клеток, причем наличие первых подтверждает диагноз «лимфома», а вторых – диагноз «воспаление», то есть ВЗК (рис. 5).
A – окрашивание гематоксилином и эозином (H&E) показывает плотные инфильтраты с мономорфной популяцией небольших зрелых лимфоцитов в собственной пластинке и эпителии.
B – иммуногистохимия с использованием антител против Т-клеточного рецептора CD3 подтверждает, что большинство лимфоцитов, видимых при окрашивании H&E, положительные для CD3 и, следовательно, относятся к линии Т-клеток.
Комплексное исследование архитектуры, фенотипа и клональности слизистой оболочки желудочно-кишечной лимфомы у кошек, опубликованное в 2012 г. (Moore et al.), показало, что около 16% алиментарных лимфом были B-клеточного происхождения и все они являлись крупноклеточными лимфомами55. Большинство (около 84%) лимфом кишечника были Т-клеточными, из них около 85% являлись МЛ. Из одиннадцати Т-клеточных лимфом, которые рассматривались как крупноклеточные, девять относились к лимфомам из больших гранулярных лимфоцитов. Эта форма может иметь происхождение из цитотоксических Т-клеток или естественных клеток-киллеров, поскольку оба типа клеток имеют внутрицитоплазматические эозинофильные гранулы. Подавляющее большинство гранулярных лимфом возникает в желудочно-кишечном тракте, вызывая сегментарное или центробежное утолщение, либо множественные образования в тонком кишечнике. Могут поражаться тощая кишка, подвздошная кишка, илеоцекальный клапан, двенадцатиперстная кишка и толстый отдел кишечника. Распространены поражения вне желудочно-кишечного тракта, которые включают лимфатические узлы брюшной полости, печень, селезенку или почки. Лимфомы из больших гранулярных лимфоцитов часто легко диагностировать с помощью тонкоигольной аспирационной биопсии с последующим цитологическим исследованием полученных образцов, и обычно не требуют проведения хирургической биопсии. Окрашивание H&E может быть использовано для постановки окончательного диагноза, поскольку при этом окрашиваются эозинофильные гранулы и гранзимы B.
МЛ часто могут сопровождаться воспалением, поэтому диагноз может быть затруднен даже при проведении ИГХ. В связи с этим были разработаны другие методы оценки клональности рецепторов лимфоцитов54.
Тесты на определение клональности
Клональность можно оценить различными способами, включая проточную цитометрию, саузерн-блот и ПЦР. Для реаранжировки рецепторного антигена (PARR) наиболее применяемым методом является ПЦР, поскольку для его проведения можно использовать образцы ткани, зафиксированные в формалине и заключенные в парафиновые блоки54.Фактически любое вещество может быть мишенью иммунного ответа, а иммунные ответы опосредуются чрезвычайно разнообразными рецепторами антигенов. Фактически разнообразие В-клеточных иммуноглобулиновых рецепторов (Ig) или Т-клеточных рецепторов (TCR) оценивается примерно в 1018 типов1.
Подобное разнообразие стало возможным благодаря соматической перестройке последовательностей ДНК зародышевой линии внутри лимфоцитов. Анализы клональности позволяют наблюдать разнообразие рецепторов антигена. Присутствие различных рецепторов предполагает наличие воспалительных поражений (т.е. поликлональных), в то время как однородные рецепторы указывают на неопластические поражения (т.е. клональные). Однако даже несмотря на то, что праймеры, используемые в анализах PARR, специфичны для T- или B-клеток, клеточная линия не может быть определена с помощью PARR. Примерно в 10% случаев Т-клетки могут перестраивать гены рецепторов В-клеток и наоборот в процессе перестройки перекрестных клонов3. Следовательно, анализы клональности не следует использовать для определения происхождения клона.
Клональность часто подразумевает бессмертие и неограниченный митоз, как это наблюдается в случаях с лимфомой. Однако клональность не всегда означает злокачественность. Доброкачественные клональные экспансии были описаны при различных заболеваниях у людей2,46 и собак21, и это хорошо задокументированный феномен у пожилых, в остальном здоровых людей60. Аналогичным образом недавние исследования по оценке клональности у людей и кошек показали, что ее специфичность составляет всего 54,3% у людей39 и 33,3% – у кошек47,49. Следовательно, ИГХ и PARR всегда нужно интерпретировать одновременно и в контексте всех доступных исследований, в идеале проведенных в одной лаборатории.
В недавней публикации авторской группой была изучена новая технология с использованием масс-спектрометрии, сопровождающейся гистологическим контролем (HMGS), для дифференциации ВЗК и МЛ49. Подобно PARR, этот метод может применяться к образцам ткани, зафиксированным в формалине и заключенным в парафиновые блоки, и, по-видимому, этот тест имеет превосходную чувствительность и специфичность (86,7% и 91,7% соответственно), однако он пока недоступен в продаже.
Лечение и прогноз ВЗК и МЛ
У кошек терапевтическое лечение ВЗК может быть схожим на лечение при МЛ в зависти от стадии заболевания, темперамента кошки и предпочтений владельца (например, умение давать кошке препараты в таблетированной форме). Однако общие дифференциальные диагнозы для ВЗК и МЛ включают эозинофильный синдром, грибковые заболевания, промежуточные/крупноклеточные лимфомы и другие неопластические процессы желудочно-кишечного тракта, при которых терапия и прогноз сильно различаются. Следовательно, взятие образцов для биопсии необходимо для диагностики и исключения других заболеваний.Лечение ВЗК у кошек обычно предполагает применение стероидов с одновременным подбором диеты (или без нее) с использованием нового белкового корма или диеты с гидролизами белка. В таблице 4 показаны плюсы и минусы различных диетических подходов для кошек с ВЗК. Важно оценить роль еды и угощений в отношениях между хозяином и кошкой. Обычно лакомства играют большую роль в общении с собаками, но некоторые владельцы кошек также поощряют лакомствами своих питомцев. Соблюдение диеты – один из важнейших компонентов лечения, и в тех случаях, когда для владельцев животных важно использовать угощение в общении с питомцами, новая белковая диета может быть предпочтительнее. Обычно для введения в рацион нового белка в качестве угощения используют небольшие термически обработанные или сушеные кусочки мяса (например, оленины). Хотя, по мнению автора, это часто бывает условно, кошки, которые реагируют только на смену корма, имеют диетозависимую энтеропатию (ДЗЭ). Независимо от типа диеты, нутритивная поддержка имеет первостепенное значение, особенно потому, что многие кошки страдают мальабсорбцией и/или уже имеют недостаток массы тела. Могут быть полезны стимуляторы аппетита, такие как миртазапин – по 1/4 таблетки 7,5 мг перорально каждые 48 часов или 2 мг на кошку в виде трансдермальной мази, наносимой на внутреннюю поверхность ушной раковины каждые 24 часа. Однако, если у кошки постоянно отсутствует аппетит или она страдает анорексией, ей следует установить пищеводный зонд (эзофагостому) для обеспечения адекватного потребления калорий и предотвращения таких осложнений, как липидоз печени38,41.
Энергетическую потребность в состоянии покоя (англ. resting energy requirement, RER) можно рассчитать по следующей формуле: 70 × (массы тела [BW] в кг)0,75. Соответственно, можно составлять рацион, разделив суточный объем на 4–6 кормлений. Если кошке требуется сухой корм, кусочки можно измельчить блендером в порошок с последующим добавлением воды до получения желаемой консистенции. Важно начинать с 25% RER в течение первых 24 часов и увеличивать на 25% каждый день до достижения 100%.
Есть доказательства (убедительные в отношении людей20, но слабые в отношении собак63) того, что пробиотики, особенно VSL#3 (теперь переименованный в Visbiome), могут быть полезными для лечения хронических энтеропатий. В настоящее время не существует систематических исследований, проведенных с участием кошек и подтверждающих эффективность применения у этих животных пробиотиков при хронической энтеропатии. Тем не менее автор обнаружил, что пробиотики полезны для некоторых кошек в качестве одной из стратегий лечения в общем многокомпонентном подходе. Кошек, страдающих идиопатическим ВЗК, обычно дополнительно лечат преднизолоном в дозе 2 мг/кг/день (можно разделить на приемы каждые 12 часов в зависимости от переносимости пациентом)30,31. Дозу преднизолона обычно снижают на 25% каждые 3–4 недели до тех пор, пока не будет определена самая низкая эффективная доза. Несмотря на то что кошки в основном толерантны к побочным эффектам стероидов, будесонид (3 мг/м2 каждые 24 часа) неофициально использовался в качестве альтернативы для лечения пациентов с непереносимостью системных стероидов (например, кошек с сахарным диабетом). Кошкам с тяжелой формой мальабсорбции может быть полезно начальное лечение подкожными инъекциями дексаметазона до тех пор, пока болезнь не будет лучше контролироваться. По опыту автора, многие кошки с МЛ первоначально также реагируют на лечение стероидами. В случае рефрактерного ВЗК или МЛ к схеме лечения можно добавить хлорамбуцил. Этот препарат можно вводить непрерывно в дозе 2 мг на кошку перорально каждые 48–72 часа (обычно в домашних условиях) или в виде пульсовой дозы 20 мг/м2 каждые 2 недели36,44,59,71. Автор также использовал импульсное дозирование хлорамбуцила для капризных кошек и/или в тех случаях, когда владелец не может давать питомцу таблетки при наличии ВЗК и МЛ. В таких случаях мы предлагаем клиентам вводить хлорамбуцил в больнице каждые 2–3 недели.
Среднее время выживания кошек с МЛ составляет от 1,5 до 3 лет36,44,59,71. Интересно, что данные о времени выживания кошек с ВЗК ограничены. В недавнем исследовании при медиане периода наблюдения, составляющего 3 года, отмечалось, что ни одна из кошек с диагнозом «лимфоплазмоцитарный энтерит» не достигла этого срока66.
Заключение
ХЭК – это общий термин для множества различных заболеваний ЖКТ, включая ДЗЭ, ВЗК и МЛ. Дифференциация ВЗК и МЛ у кошек остается сложной задачей.Учитывая возможность того, что хроническое воспаление у кошек с ВЗК со временем может прогрессировать до МЛ, важно не упустить момент этой трансформации. С терапевтической и прогностической точек зрения дифференциация в настоящее время не может повлиять ни на подход к терапии, ни на ее результат. Однако многие вопросы остаются без ответа, например: «Каковы причины значительного увеличения заболеваемости с течением времени?», «Существуют ли различные формы МЛ (эпителиотропная по сравнению с поражением в собственной пластинке, слизистая или трансмуральная локализация в тонкой кишке, поражение лимфатических узлов и т. д.)?» и «Должны ли мы подбирать другую тактику лечения?». Необходимо продолжить изучение комплекса патологий, объе6диненных термином ХЭК, для совершенствования методов диагностики и лечения.
Список литературы:
- Actor J. K. (2012). Elsevier’s Integrated Review Immunology and Microbiology Chapter 4.
- T-cell Immunity. 2nd Edition. Elsevier.
- Alaibac M., Daga A., Harms G., et al. (1993). Molecular analysis of the gamma delta T-cell receptor repertoire in normal human skin and in oriental cutaneous leishmaniasis. Experimental Dermatology 2, 106-112.
- Andrews C., Operacz M., Maes R., et al. (2016). Cross lineage rearrangement in feline enteropathy-associated T-cell lymphoma. Veterinary Pathology 53, 559-562.
- Barrs V. R. & Beatty J. A. (2012a). Feline alimentary lymphoma 2. Further diagnostics, therapy and prognosis. Journal of Feline Medicine and Surgery 14, 191-201.
- Barrs V. R. & Beatty,J. A. (2012b). Feline alimentary lymphoma: 1. Classification, risk factors, clinical signs and noninvasive diagnostics. Journal of Feline Medicine and Surgery 14, 182-190.
- Barrs V. R., Beatty J. A., Mccandlish, I. A., et al. (2002). Hypereosinophilic paraneoplastic syndrome in a cat with intestinal T cell lymphosarcoma. The Journal of Small Animal Practice 43, 401-405.
- Bernstein L. H., Gutstein S., Weiner S., et al. (1970). The absorption and malab sorption of folic acid and its polyglutamates. The American Journal of Medicine 48, 570-579.
- Bjerrum J. T., Wang Y., Hao F., et al. (2015). Metabonomics of human fecal extracts characterize ulcerative colitis, Crohn’s disease and healthy individuals. Metabolomics 11, 122-133.
- Burke K. F., Broussard J. D., Ruaux C. G., et al. (2013). Evaluation of fecal α1 proteinase inhibitor concentrations in cats with idiopathic inflammatory bowel disease and cats with gastrointestinal. Neoplasia 196, 189-196.
- Butterworth C. E., Baugh C. M. & Krumdieck C. (1969). A study of folate absorption and metabolism in man utilizing carbon-14—labeled polyglutamates synthesized by the solid phase method. The Journal of Clinical Investigation 48, 1131-1142.
- Chow B., Hill S. L., Richter K. P., et al. (2021). Comprehensive comparison of upper and lower endoscopic small intestinal biopsy in cats with chronic enteropathy. Journal of Veterinary Internal Medicine 35, 190-198.
- Collette S. A., Allstadt S. D., Chon E. M., et al. (2016). Treatment of feline intermediate- to high-grade lymphoma with a modified university of Wisconsin-Madison protocol: 119 cases (2004-2012). Veterinary and Comparative Oncology 14(Suppl 1), 136-146.
- Cook A. K., Cunningham L. Y., Cowell A. K., et al. (2012). Clinical evaluation of urine Histoplasma capsulatum antigen measurement in cats with suspected disseminated histoplasmosis. Journal of Feline Medicine and Surgery 14, 512- 515.
- Cruz-Jentoft A. J., Bahat G., Bauer J., et al. (2019). Sarcopenia: revised European consensus on definition and diagnosis. Age and Ageing 48, 16-31.
- Daniaux L. A., Laurenson M. P., Marks S. L., et al. (2014). Ultrasonographic thickening of the muscularis propria in feline small intestinal small cell T-cell lymphoma and inflammatory bowel disease. Journal of Feline Medicine and Surgery 16, 89-98.
- Day M. J., Bilzer T., Mansell J., et al. (2008). Histopathological standards for the diagnosis of gastrointestinal inflammation in endoscopic biopsy samples from the dog and cat: a report from the World Small Animal Veterinary Association Gastrointestinal Standardization Group. Journal of Comparative Pathology 138(Suppl 1), S1-S43.
- De Souza H. S. & Fiocchi C. (2016). Immunopathogenesis of IBD: current state of the art. Nature Reviews Gastroenterology & Hepatology 13, 13-27.
- DeSouza,H.S.P.,Fiocchi,C.&Iliopoulos,D.(2017)TheIBDinteractome:an integrated view of aetiology, pathogenesis and therapy. Nature Reviews. Gastroenterology & Hepatology 14, 739-749.
- Dennis J. S., Kruger J. M. & Mullaney T. P. (1992). Lymphocytic/plasmacytic gastroenteritis in cats: 14 cases (1985-1990). Journal of the American Veterinary Medical Association 200, 1712-1718.
- Derwa Y. Gracie D. J. Hamlin P. J. et al. (2017). Systematic review with metaanalysis: the efficacy of probiotics in inflammatory bowel disease. Alimentary Pharmacology & Therapeutics 46, 389-400.
- Diehl K. J., Lappin M. R., Jones R. L., et al. (1992). Monoclonal gammopathy in a dog with plasmacytic gastroenterocolitis. Journal of the American Veterinary Medical Association 201, 1233-1236.
- Finotello R., Vasconi M. E., Sabattini S., et al. (2018). Feline large granular lymphocyte lymphoma: an Italian Society of Veterinary Oncology (SIONCOV) retrospective study. Veterinary and Comparative Oncology 16, 159-166.
- Fyfe J. (1993). Feline intrinsic factor (IF) is pancreatic in origin and mediates ileal cobalamin (CBL) absorption. Journal of Veterinary Internal Medicine 7, 133.
- Fyfe J. C., Madsen M., Højrup P., et al. (2004). The functional cobalamin (vitamin B12)–intrinsic factor receptor is a novel complex of cubilin and amnionless. Blood 103, 1573-1579.
- Gouldin E. D., Mullin C., Morges M., et al. (2017). Feline discrete high-grade gastrointestinal lymphoma treated with surgical resection and adjuvant CHOP- based chemotherapy: retrospective study of 20 cases. Veterinary and Comparative Oncology 15, 328-335.
- Guttin T., Walsh A., Durham A. C., et al. (2019). Ability of ultrasonography to predict the presence and location of histologic lesions in the small intestine of cats. Journal of Veterinary Internal Medicine 33, 1278-1285.
- Habibi F., Habibi M. E., Gharavinia A., et al. (2017). Quality of life in inflammatory bowel disease patients: a cross-sectional study. Journal of Research in Medical Sciences: The Official Journal of Isfahan University of Medical Sciences 22, 104.
- Hendrick M. (1981). A spectrum of hypereosinophilic syndromes exemplified by six cats with eosinophilic enteritis. Veterinary Pathology 18, 188-200.
- Janeczko S., Atwater D., Bogel E., et al. (2008). The relationship of mucosal bacteria to duodenal histopathology, cytokine mRNA, and clinical disease activity in cats with inflammatory bowel disease. Veterinary Microbiology 128, 178-193.
- Jergens A. E. (2012). Feline idiopathic inflammatory bowel disease: what we know and what remains to be unraveled. Journal of Feline Medicine and Surgery 14, 445-458.
- Jergens A. E., Moore F. M., Haynes J. S., et al. (1992). Idiopathic inflammatory bowel disease in dogs and cats: 84 cases (1987-1990). Journal of the American Veterinary Medical Association 201, 1603-1608.
- Jergens A. E., Schreiner C. A., Frank D. E., et al. (2003). A scoring index for disease activity in canine inflammatory bowel disease. Journal of Veterinary Internal Medicine 17, 291-297.
- Jergens A. E., Crandell J. M., Evans R., et al. (2010). A clinical index for disease activity in cats with chronic enteropathy. Journal of Veterinary Internal Medicine 24, 1027-1033.
- Jergens A. E., Evans R. B., Ackermann M., et al. (2014). Design of a simplified histopathologic model for gastrointestinal inflammation in dogs. Veterinary Pathology 51, 946-950.
- Jergens A. E., Willard M. D. & Allenspac, K. (2016). Maximizing the diagnostic utility of endoscopic biopsy in dogs and cats with gastrointestinal disease. Veterinary Journal 214, 50-60.
- Kiselow M. A., Rassnick K. M., Mcdonough S. P., et al. (2008). Outcome of cats with low-grade lymphocytic lymphoma: 41 cases (1995-2005). Journal of the American Veterinary Medical Association 232, 405-410.
- Kiupel M., Smedley R. C., Pfent C., et al. (2011). Diagnostic algorithm to differentiate lymphoma from inflammation in feline small intestinal biopsy samples. Veterinary Pathology 48, 212-222.
- Klaus J. A., Rudloff E. & Kirby R. (2009). Nasogastric tube feeding in cats with suspected acute pancreatitis: 55 cases (2001-2006). Journal of Veterinary Emergency and Critical Care 19, 337-346.
- Kokovic I., Novakovic B. J. Cerkovnik, P. et al. (2014). Clonality analysis of lymphoid proliferations using the BIOMED-2 clonality assays: a single institution experience. Radiology and Oncology 48, 155-162.
- Kolho K. L., Pessia A., Jaakkola T., et al. (2017). Faecal and serum metabolomics in paediatric inflammatory bowel disease. Journal of Crohn’s & Colitis 11, 321- 334.
- Kuzi S., Segev G., Kedar S., et al. (2017). Prognostic markers in feline hepatic lipidosis: a retrospective study of 71 cats. Veterinary Record 181, 512-512.
- Lalor S.,Schwartz A. M., Titmarsh H., et al. (2014). Cats with inflammatory bowel disease and intestinal small cell lymphoma have low serum concentrations of 25-hydroxyvitamin D. Journal of Veterinary Internal Medicine 28, 351-355.
- Limmer S., Eberle N., Nerschbach V., et al. (2016). Treatment of feline lymphoma using a 12-week, maintenance-free combination chemotherapy protocol in 26 cats. Veterinary and Comparative Oncology 14, 21-30.
- Lingard A. E., Briscoe K., Beatty J. A., et al. (2009). Low-grade alimentary lymphoma: clinicopathological findings and response to treatment in 17 cases. Journal of Feline Medicine and Surgery 11, 692-700.
- Louwerens M., London C. A., Pedersen N. C., et al. (2005). Feline lymphoma in the post-feline leukemia virus era. Journal of Veterinary Internal Medicine 19, 329-335.
- Magro C. M., Crowson A. N., Kovatich A. J., et al. (2003). Drug-induced reversible lymphoid dyscrasia: a clonal lymphomatoid dermatitis of memory and activated T cells. Human Pathology 34, 119-129.
- Marsilio S., Ackermann M. R., Lidbury J. A., et al. (2019a). Results of histopathology, immunohistochemistry, and molecular clonality testing of small intestinal biopsy specimens from clinically healthy client-owned cats. Journal of Veterinary Internal Medicine 33, 551-558.
- Marsilio S., Pilla R., Sarawichitr B., et al. (2019b). Characterization of the fecal microbiome in cats with inflammatory bowel disease or alimentary small cell lymphoma. Scientific Reports 9, 19208.
- Marsilio S., Newman S. J., Estep J. S., et al. (2020). Differentiation of lymphocytic-plasmacytic enteropathy and small cell lymphoma in cats using histology- guided mass spectrometry. Journal of Veterinary Internal Medicine 34, 669-677.
- Maunder C. L., Day M. J., Hibbert A., et al. (2012). Serum cobalamin concentrations in cats with gastrointestinal signs: correlation with histopathological findings and duration of clinical signs. Journal of Feline Medicine and Surgery 14, 686-693.
- Mavropoulou A., Grandi G., Calvi, L., et al. (2010). Disseminated histoplasmosis in a cat in Europe. Journal of Small Animal Practice 51, 176-180.
- McEwen S. A. Valli V. E. & Hulland T. J. (1985). Hypereosinophilic syndrome in cats: a report of three cases. Canadian Journal of Comparative Medicine 49, 248-253.
- Minamoto Y., Otoni C. C., Steelman S. M., et al. (2015). Alteration of the fecal microbiota and serum metabolite profiles in dogs with idiopathic inflammatory bowel disease. Gut Microbes 6, 33-47.
- Moore P. F., Woo J. C., Vernau W., et al. (2005). Characterization of feline T-cell receptor gamma (TCRG) variable region genes for the molecular diagnosis of feline intestinal T-cell lymphoma. Veterinary Immunology and Immunopathology 106, 167-178.
- Moore P. F., Rodriguez-Bertos A. & Kass P. H. (2012). Feline gastrointestinal lymphoma: mucosal architecture, immunophenotype, and molecular clonality. Veterinary Pathology 49, 658-668.
- Norsworthy G. D., Scot Estep J., Kiupel M., et al. (2013). Diagnosis of chronic small bowel disease in cats: 100 cases (2008-2012). Journal of the American Veterinary Medical Association 243, 1455-1461.
- Norsworthy G. D., Estep J. S., Hollinger C., et al. (2015). Prevalence and underlying causes of histologic abnormalities in cats suspected to have chronic small bowel disease: 300 cases (2008-2013). Journal of the American Veterinary Medical Association 247, 629-635.
- Paulin M. V., Couronne L., Beguin J., et al. (2018). Feline low-grade alimentary lymphoma: an emerging entity and a potential animal model for human disease. BMC Veterinary Research 14, 306.
- Pope K. V., Tun A. E., Mcneill C. J., et al. (2015). Outcome and toxicity assessment of feline small cell lymphoma: 56 cases (2000-2010). Veterinary Medicine and Science 1, 51-62.
- Posnett D. N., Sinh, R., Kabak S., et al. (1994). Clonal populations of T cells in normal elderly humans: the T cell equivalent to "benign monoclonal gammapathy". The Journal of Experimental Medicine 179, 609-618.
- Reed N., Gunn-Moore D. & Simpson K. (2007). Cobalamin, folate and inorganic phosphate abnormalities in ill cats. Journal of Feline Medicine and Surgery 9, 278-288.
- Richter K. P. (2003). Feline gastrointestinal lymphoma. The Veterinary Clinics of North America. Small Animal Practice 33, 1083-1098.
- Rossi G., Pengo G., Caldin M., et al. (2014). Comparison of microbiological, histological, and immunomodulatory parameters in response to treatment with either combination therapy with prednisone and metronidazole or probiotic VSL#3 strains in dogs with idiopathic inflammatory bowel disease.
- Ruaux C. G., Steiner J. M. & Williams D. A. (2005). Early biochemical and clinical responses to cobalamin supplementation in cats with signs of gastrointestinal disease and severe hypocobalaminemia. Journal of Veterinary Internal Medicine 19, 155-160.
- Ruiz G. C., Reyes-Gomez E., Hall E. J., et al. (2016). Comparison of 3 handling techniques for endoscopically obtained gastric and duodenal biopsy specimens: a prospective study in dogs and cats. Journal of Veterinary Internal Medicine 30, 1014-1021.
- Sabattini S., Bottero E., Turba M. E., et al. (2016). Differentiating feline inflammatory bowel disease from alimentary lymphoma in duodenal endoscopic biopsies. The Journal of Small Animal Practice 57, 396-401.
- Scott K. D., Zoran D. L., Mansell J., et al. (2011). Utility of endoscopic biopsies of the duodenum and ileum for diagnosis of inflammatory bowel disease and small cell lymphoma in cats. Journal of Veterinary Internal Medicine 25, 1253-1257.
- Simpson, K. (2015). Pancreatitis and triaditis in cats: causes and treatment. Journal of Small Animal Practice 56, 40-49.
- Simpson K. W. & Jergens A. E. (2011). Pitfalls and progress in the diagnosis and management of canine inflammatory bowel disease. The Veterinary Clinics of North America. Small Animal Practice 41, 381-398.
- Simpso, K. W., Fyfe J., Cornetta A., et al. (2001). Subnormal concentrations of serum cobalamin (vitamin B12) in cats with gastrointestinal disease. Journal of Veterinary Internal Medicine 15, 26-32.
- Stein T. J., Pellin M., Steinberg H., et al. (2010). Treatment of feline gastrointestinal small-cell lymphoma with chlorambucil and glucocorticoids. Journal of the American Animal Hospital Association 46, 413-417.
- Takeuchi Y., Matsuura S., Fujino Y., et al. (2008). Hypereosinophilic syndrome in two cats. The Journal of Veterinary Medical Science 70, 1085-1089.
- Waly N. E., Stokes C. R., Gruffydd-Jones T. J., et al. (2004). Immune cell populations in the duodenal mucosa of cats with inflammatory bowel disease. Journal of Veterinary Internal Medicine 18, 816-825.
- Waly N. E., Gruffydd-Jones T. J., Stokes C. R., et al. (2005). Immunohistochemical diagnosis of alimentary lymphomas and severe intestinal inflammation in cats. Journal of Comparative Pathology 133, 253-260.
- Washabau R. J., Day M. J., Willard M. D., et al. (2010). Endoscopic, biopsy, and histopathologic guidelines for the evaluation of gastrointestinal inflammation in companion animals. Journal of Veterinary Internal Medicine 24, 10-26.
- Weiss D., Gagne J. & Armstrong P. (1996). Relationship between inflammatory hepatic disease and inflammatory bowel disease, pancreatitis, and nephritis in cats. Journal of the American Veterinary Medical Association 209, 1114-1116.
- Willard M. D., Jergens A. E., Duncan R. B., et al. (2002). Interobserver variation among histopathologic evaluations of intestinal tissues from dogs and cats. Journal of the American Veterinary Medical Association 220, 1177- 1182.
- Willard M. D., Mansell J., Fosgate G. T., et al. (2008). Effect of sample quality on the sensitivity of endoscopic biopsy for detecting gastric and duodenal lesions in dogs and cats. Journal of Veterinary Internal Medicine 22, 1084-1089.
- Xenoulis P. G., Zoran D. L., Fosgat G. T., et al. (2016). Feline exocrine pancreatic insufficiency: a retrospective study of 150 cases. Journal of Veterinary Internal Medicine 30, 1790-1797.
- Zwingenberger A. L., Marks S. L., Baker T. W., et al. (2010). Ultrasonographic evaluation of the muscularis propria in cats with diffuse small intestinal lymphoma or inflammatory bowel disease. Journal of Veterinary Internal Medicine 24, 289-292.



 vetpeterburg
vetpeterburg Ветеринарный Петербург
Ветеринарный Петербург