Автор: Сейлиев Д. А., ветеринарный врач-хирург, онколог Ветеринарной клиники Сотникова, г. Санкт-Петербург
Для постановки точного диагноза врачу может потребоваться большое количество времени, что в ряде случаев является фактором, работающим не в пользу пациента. Поэтому при любом подозрении на грибковую инфекцию необходимо использовать практически весь спектр имеющихся диагностических методов, начиная от цитологии и заканчивая молекулярной диагностикой и посевами.
Клинический случай
Пациент: 14-летняя кошка британской породы, весом 3,8 кг, вакцинирована. Условия содержания квартирные. Кормление – смешанный рацион (натуральное кормление и кормление со стола). Ранее перенесенные заболевания: наружный отит, средний отит. Пациенту также были проведены хирургические манипуляции: овариогистерэктомия, латеральная буллотомия, удаление слухового канала. Травм не было.
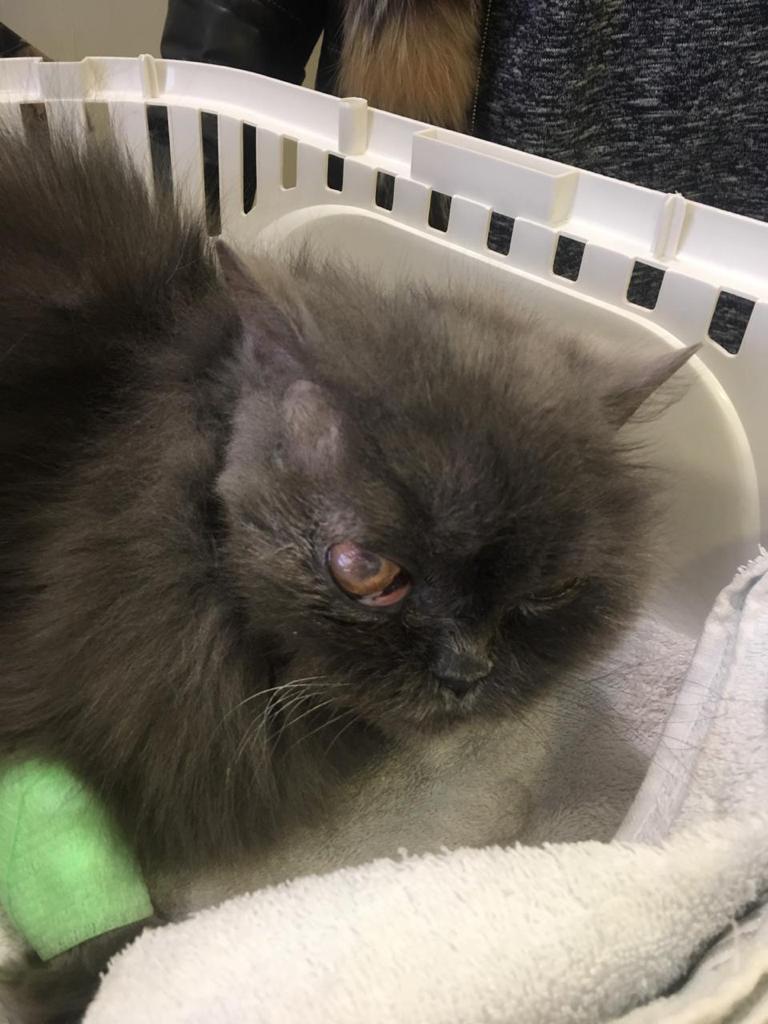
Эпикриз: клиенты обратились в ветеринарную клинику по причине угнетения общего состояния кошки, наличия у нее хронической (длительно не заживающей) раны на месте проведенной латеральной буллотомии, а также унилатерального экзофтальма, асимметрии головы (фото 1).
При осмотре выявлены: ослабление пальпебрального рефлекса лицевого нерва (CN VII), снижение рефлекса угрозы зрительного нерва (CN II), сосудистый кератит, конъюнктивит, ярко выраженный экзофтальм. Наблюдаются односторонние гнойные выделения из правого глаза, затрудненный акт глотания, отсутствие правого слухового прохода. В 2016 году по причине одностороннего среднего отита были проведены латеральная буллотомия и удаление слухового канала, на месте операции в области шва определяется свищевое отверстие.
В сторонней клинике пациенту сделали МРТ (в 2016 году), рентгенографию и бактериологическое исследование раневого отделяемого (результаты исследования, к сожалению, не были предоставлены).
Накануне, перед обращением в нашу клинику, кошке был поставлен предварительный диагноз «остеосаркома (OSA)».
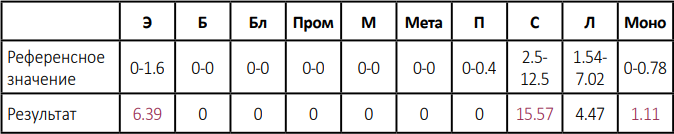
На основании результатов осмотра пациенту были сделаны скрининговое исследование сердца, общий клинический и биохимический анализы крови, также было рекомендовано проведение компьютерной томографии головы грудной и брюшной полостей на определение отдаленных метастазов.
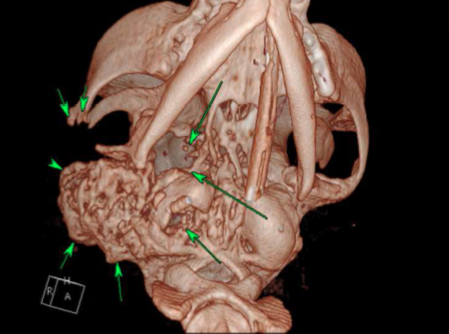
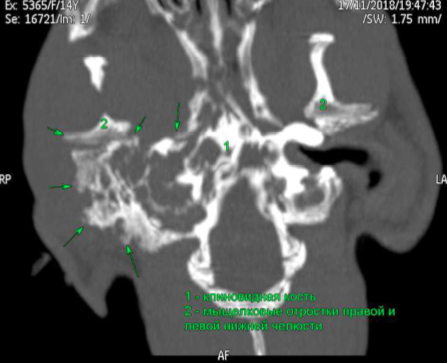
Заключение врача визуальной диагностики. Определяются обширная костная пролиферация и множественные кальцинозы мягких тканей в области мозговой части черепа, барабанной и скалистой частей правой каменистой кости, сустава, скуловой дуги, барабанного пузыря, чешуи височной кости и решетчатой кости (фото 2, 3). Патологический процесс сопровождается обширным лизисом многих костей: клиновидной кости, венечного и мыщелкового отростков правой нижней челюсти (фото 4). Границы черепа нарушены, нельзя исключать вовлечение мозговых оболочек в патологический процесс.
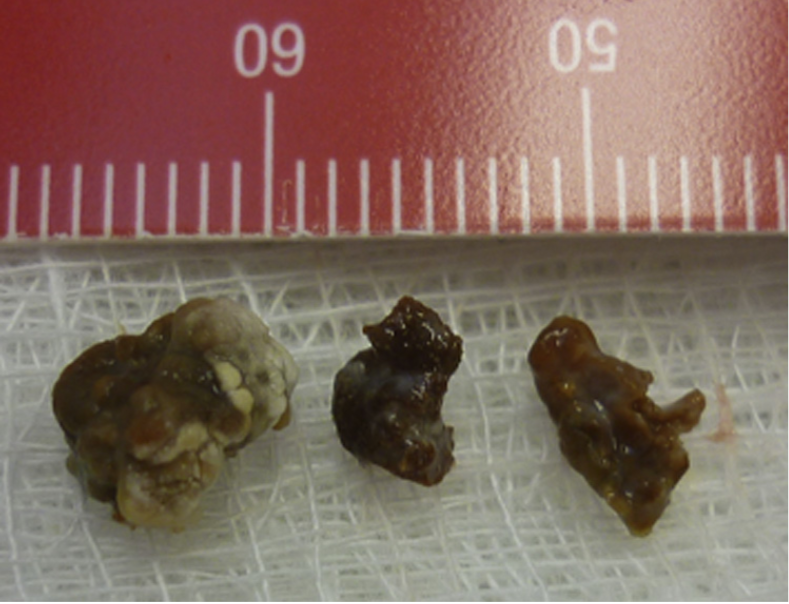
После проведенной КТ была сделана инцизионная биопсия (трепан-биопсия) с применением биопсийной иглы типа Ямшиди. Материал отправили на гистологическое, цитологическое и бактериологическое исследования (фото 5).
Заключение цитолога. При проведении цитологического исследования выявлено наличие большого количества активированных макрофагов (часть которых находится в состоянии фагоцитоза эритроцитов, лейкоцитов и гемосидерина), двухъядерных и гигантских многоядерных клеток, а также умеренного количества недегенеративных и дегенеративных нейтрофилов. Встречаются единичные малые лимфоциты. Фон базофильный, представлен большим количеством эритроцитов, разрушенными клетками.
Инфекционных агентов не обнаружено.
Комментарий: рекомендовано гистологическое исследование.
Заключение: пиогранулематозное воспаление, контаминация кровью.
Заключение гистолога. Отмечаются большие скопления макрофагов с обильной вакуолизированной цитоплазмой, эпителиоидные клетки, а также нейтрофильные лейкоциты, участки некроза. Представлены обширные участки, содержащие массы, напоминающие гифы грибов. Встречаются участки реактивной кости.
Морфологический диагноз биоптатов тканей головы (область доподлинно не определяется в срезах): хроническое диффузное гранулематозное воспаление, вероятно, вызванное грибами.
Диагноз: наиболее вероятно наличие грибковой гранулемы.
Комментарий: во всех образцах отмечаются крупные скопления организмов, напоминающих гифы грибов.
Аспергиллез может проявляться в виде местной или системной инфекции у многих видов животных, в том числе и у кошек.
Половая или породная предрасположенность у кошек отсутствует.
Существует несколько форм болезни: синоназальная, синоорбитальная, назальная.
У иммуносупрессивных животных чаще встречается системная инфекция (на фоне панлейкопении, ВЛК, при инфекционном перитоните, также отмечалась у кошки с сахарным диабетом при длительном лечении глюкокортикоидами).
Рекомендована дополнительная окраска PAS и/или ПЦР на аспергиллез.
Прогноз: удовлетворительный.
Для проведения ПЦР-диагностики на аспергиллез бал отобран материал с гистологического парафинового блока. Для проведения посева на грибковую флору с целью определения возбудителя потребовался повторный забор биопсийного материала. Все необходимые материалы были направлены в НИИ медицинской микологии им. П.Н.Кашкина.
Результат исследования: ПЦР на аспергиллез отрицательный.
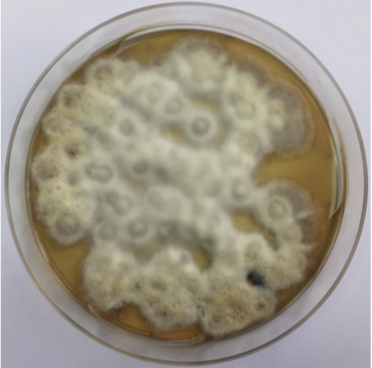
Результат посева на грибковую флору: при посеве смыва с раневого содержимого не выявлено роста микроорганизмов; при посеве раневого содержимого выделены грибы Trichophyton spp. (фото 6).
Лечение:- итраконазол (Itraconazole; «Итразол 100») – 5 мг/кг;
- амоксициллин + клавулановая кислота в дозировке 12,5 мг/кг.
Можно сделать вывод, что первичной причиной среднего отита было грибковое поражение, спорами которого были обсеменены мягкие ткани операционной раны в процессе оперативного вмешательства (проведения латеральной буллотомии). Назначенная неспецифическая антибактериальная терапия не была эффективной, что стало причиной распространения данного типа возбудителя и привело к медленному течению болезни с периодически рецидивирующей реинфекцией и свищеванием операционной раны. В конечном итоге данный патологический процесс вызвал такое состояние пациента, а также осложнение в виде распространения инфекции.
Для адекватного лечения отита необходима полная диагностика, включающая КТ, МРТ, эндоскопическое исследование, бактериологическое и цитологическое исследования содержимого буллы.
На момент написания статьи состояние кошки стабильное, прекратилось свищевание раневых каналов, но полностью такого пациента вылечить, к сожалению, невозможно (фото 7).
Этиология и патогенез
Trichophyton spp. вызывает кожную инфекцию, при этом на коже образуются папулоподобные образования. Инфекция может легко распространяться на другие участки тела, а также сохраняться на вещах, подстилке и в окружающей среде. Эти грибки размножаются в теплых, влажных, темных местах, например в ороговевающих верхних слоях кожи, кожных складках, труднодоступных для воздуха местах. Споры грибов устранить чрезвычайно трудно. Когда гифы гриба внедряются в кожные покровы и высвобождают ферменты для растворения кератина, они могут вызывать раздражение нервных окончаний. Это приводит к зуду, который, в свою очередь, провоцирует расчесывание кожи, что позволяет переносить частички кожи, и, соответственно, грибок распространяется на другие части тела хозяина. Царапины также облегчают распространение грибков вглубь кожи. Данный диагноз не является специфическим, установить его без применения специальных сред и знания предварительного возбудителя практически невозможно.
Для адекватной дифференциальной диагностики инфекционного процесса необходимо проводить обязательное цитологическое исследование содержимого буллы при отитах. Это поможет избежать возникновения подобных осложнений при проведении буллотомии. Напоминаем, что основными возбудителями среднего отита являются Pseudomonas aeruginosa, Enterococcus spp., Staphylococcus intermedius, Corynebacterium spp., Streptococcus group G, Proteus mirabilis и Aspergillus fumigatus.
Trichophyton является представителем зоофильных грибов, которые первоначально были обнаружены у животных, но могут передаваться человеку и, следовательно, вызывать усиление воспалительной реакции. Другими распространенными у человека зоофильными грибами являются Trichophyton verrucosum, Trichophyton equinum, Microsporum canis, Microsporum gallinae и Microsporum nanum.
Обычно отмечается, что дикие и домашние животные могут быть переносчиками патогенных грибов. Наиболее распространенными носителями, передающими болезни, являются кошки, морские свинки, мыши, крысы и хомяки. В целом Trichophyton mentagrophytes является наиболее часто выделяемым зоонозным патогеном. Как правило, у зараженных животных не наблюдается типичных симптомов (нет типичных симптомов микотической инфекции). Эта проблема была выявлена в процессе изучения грибковой флоры сапрофитного характера у лабораторных животных и описана в литературе с 1970-х годов1.
Тщательное обследование пациентов на предмет возможной этиологии патогенных грибов является обязательным условием своевременной диагностики. При подозрении на наличие грибковой флоры можно использовать образцы соскобов волос или кожи эпидермиса.
Долгосрочный мониторинг как с клинической, так и с микологической оценкой важен у пациентов с фоновыми иммуносупрессивными заболеваниями в анамнезе, а также у тех пациентов, которые получали иммунодепрессанты, такие как противоопухолевые препараты (ингибиторы TNF-а, VEGF и пр.), – они могут вызывать значимую миелосупрессию, что, в свою очередь, может привести к появлению грибковых колоний и гранулем5.
Рекомендуется профилактика, которая включает предотвращение окклюзии волосяного фолликула, местное применение стероидов и удаление волосяного покрова2 6. Подобный микоз можно классифицировать по участию системы организма, длительности инфекции, патологии и патогенезу. Чаще всего заболевание классифицируется как инвазивное, если происходит инвазия гифа в ткани. Непосредственное исследование волос под микроскопом может указывать на находящиеся там споры, расположенные преимущественно на поверхности волосяного стержня без инвазии в волосяную клетку. Иногда гриб также проникает в кутикулу волоса, и наблюдаются четырехсторонние споры, образующие цепь.
Обычно заболевание требует системной противогрибковой терапии. В настоящее время чаще всего назначают итраконазол и тербинафин. Продолжительность терапии должна составлять не менее 4–8 недель, и лечение следует продолжать до тех пор, пока не исчезнут все поражения2.
Тербинафин рекомендуется для кошек и собак в дозе 30–40 мг/кг перорально однократно, один раз в день (Moriello, 2004)22. В дополнение к его превосходной эффективности в устранении дерматофитов тербинафин имеет значительно более низкий риск взаимодействия с другими лекарственными средствами2 3 4.
Итраконазол также с уверенностью может быть использован при лечении микозов. В данном случае при выборе препарата стоит полагаться на собственный опыт, знание фармакодинамики, побочных действий и общего состояния пациента. Рекомендованные дозы итраконазола – 10 мг/кг перорально ежедневно. Препарат обязательно следует давать с едой (Legendre and Toal, 2000)22.
Aspergillus. Именно с этим видом гриба, вызывающим разностороннюю клиническую картину в зависимости от его типа, тропности, вирулентности и места инвазии, мы чаще всего сталкиваемся в рутинной ветеринарной практике. Клиническое проявление у данных типов микозов схожи, поэтому разберем основные формы проявления аспергиллеза.
Респираторный тракт является наиболее распространенным местом возникновения заболеваний у людей и животных, отражающим основной путь ингаляционного заражения.
Инвазивный аспергиллез (IA) встречается преимущественно в дыхательном тракте у пациентов с ослабленным иммунитетом и связан с вдыханием спор Aspergillus spp. Он является причиной более 90 % случаев IA.
Аспергиллез верхних дыхательных путей (upper respiratory tract aspergillosis; URTA) встречается реже и классифицируется как инвазивный или неинвазивный микотический риносинусит. Однако URTA является наиболее распространенной формой аспергиллеза, который регистрируют (в основном) у иммуносупрессивных кошек и собак7 8. URTA можно подразделить на синоназальный аспергиллез (SNA) и синоорбитальный аспергиллез (SOA). У собак SNA встречается в более чем 99 % случаев и является неинвазивным, тогда как у кошек наиболее распространенной форма – SOA, являющаяся инвазивной (65 % случаев)1 4 5 7 9-18.
Распространенный инвазивный аспергиллез (IA) обычно регистрируется у пациентов с ослабленным иммунитетом и определяется как активная инфекция в двух или более несмежных местах или рассматривается как гематогенное распространение заболевания.
Существует несколько сообщений о распространенном IA у кошек, у которых в большинстве случаев имелось легочное вовлечение. non-URTA инвазивные инфекции также были зарегистрированы у кошек с поражением легких19-21, желудочно-кишечного тракта или мочевого пузыря19.
Диссеминированные и очаговые IA
Виды Aspergillus, вызывающие диссеминированный и очаговый IA у кошек, в основном остаются неизвестными, поскольку в большинстве случаев заболевания были диагностированы после смерти пациентов только по гистологическим данным19. Грибковая гранулема была идентифицирована по морфологии грибковых культур только у двух кошек с микотической пневмонией, у одной кошки с микотическим циститом, у одной – с диссеминированным и у одной – с аспергиллезным отитом IA18. Возбудитель был идентифицирован по морфологии грибковой культуры только у одной кошки с микотическим циститом19. Молекулярного подтверждения идентичности возбудителя не было выполнено ни в одном случае.
Диагноз
Диагностика URTA у кошек требует использования различных комбинаций серологии, современных методов визуализации (КТ, МРТ), риносиноскопии, цитологии, гистологии, грибкового культивирования и молекулярной идентификации.
Окончательный диагноз основан на выявлении грибковых гиф при цитологическом или гистологическом исследовании биоптатов тканей или синоназальных грибковых бляшек. Как и в случае с SNA у собак, диагноз может быть поставлен путем визуализации грибковых бляшек на слизистой оболочке носа и других полостей при эндоскопии4. Однако, учитывая более разнообразный спектр грибковых патогенов, которые могут вызывать URTA у кошек, всегда следует пытаться определить патогенные микроорганизмы грибов.
Гематология и биохимия
Гематология обычно ничем не примечательна либо может выявить признаки воспалительного процесса по лейкограмме (фото 8). Периферическая эозинофилия встречается редко (в 10 % случаев)7 8 10 11 16 (фото 9). Легкая и выраженная гиперглобулинемия является наиболее распространенной патологией в биохимии сыворотки, о выявлении которой сообщалось у 9 из 16 кошек с SOA и у одной кошки с SNA, вызванным инфекцией A. felis7 10 11. Данное открытие указывает на то, что у кошек с подтвержденным URTA наличие гиперглобулинемии является маркером инвазивного заболевания, однако для анализа этого необходимы дальнейшие проспективные исследования.
Результаты КТ при SOA
КТ-особенности SOA, которые наблюдаются при злокачественных новообразованиях носа (например, при назальных лимфомах, карциномах носа, фибромах и фибросаркомах), схожи с другими инвазивными микозами, такими как криптококкоз14. Подобные клинические проявления включают лизис костей носа или иных сопряженных с патологическим процессом костных структур, умеренное или сильное разрушение носовых раковин, масс-эффект и распространение гранулемы в область орбиты и ретробульбарного пространства16–18.
Процедуры биопсии
Эндоскопическая визуализация синоназальной полости может быть выполнена с использованием назофарингоскопии, риноскопии и синусоскопии. Образцы отбираются для цитологии и/или гистологии и бактериологического исследования методом эксцизионной биопсии. Они могут храниться в замороженном виде для определения возбудителя методом ПЦР, если есть подозрение на URTA, но предыдущие методы исследования не давали возможности подтвердить наличие грибковой культуры.
С целью получения большего количества образцов (для гистологического, цитологического, бактериологического исследований) можно применять метод промывания или ирригации носовой и прочих полостей. Данную процедуру можно проводить как эндоскопически, так и вслепую. Ряд литературных источников рекомендует для получения материала осуществлять именно ирригацию, поскольку в этом случае объем получаемых образцов для цитологического и бактериологического исследований будет больше, соответственно, шансы на подтверждение микоза увеличатся, но при этом не нужно забывать о плюсах и минусах любого метода отбора.
Синусоскопия показана в случаях, когда результаты КТ указывают на поражение пазухи, а грибковые наложения не визуализируются при риноскопии.
Лечение и прогноз
SOA имеет плохой долгосрочный диагностический прогноз. Оптимальные протоколы для лечения SOA не были определены. С учетом ответов на лечение в отдельных случаях7 10 11 16 рекомендуется следующий терапевтический подход – использование позаконазола или итраконазола в виде монотерапии. В некоторых случаях может потребоваться введение системных противогрибковых препаратов в течение 6 месяцев или дольше, хотя при этом возможны реинфекция, рецидив инфекции.
Выводы
URTA у кошек (наиболее распространенная форма аспергиллеза у кошек) начинается с появления инфекции в полости носа. При синоназальном аспергиллезе (SNA) инфекции остаются ограниченными синоназальной полостью. При синоорбитальном аспергиллезе (SOA), который является инвазивным микозом, инфекция распространяется из полости носа и вовлекает околоносовые структуры, включая орбиту. В отличие от SNA у собак, URTA у кошек вызывается разнообразными видами Aspergillus (в основном из комплекса A. fumigatus).
Фенотипические методы идентификации ненадежны, но грибы можно легко идентифицировать с помощью ПЦР. Для постановки точного диагноза врачу может потребоваться большое количество времени, что в ряде случаев является фактором, работающим не в пользу пациента. Поэтому при любом подозрении на грибковую инфекцию необходимо использовать практически весь спектр имеющихся диагностических методов, начиная от цитологии и заканчивая молекулярной диагностикой и посевами.
-
Declercq J., Declercq L., Fincioen S. Unilateral sino-orbital and subcutaneous aspergillosis in a cat. Vlaams Diergeneeskd Tijdschr, 81 (6): 357–62, 2012.
-
Whitney B. L., Broussard J., Stefanacci J. D. Four cats with fungal rhinitis. J Feline Med Surg, 7(1): 53–8, 2005.
-
Kano R., Itamoto K., Okuda M., et al. Isolation of Aspergillus udagawae from a fatal case of feline orbital aspergillosis. Mycoses, 51(4): 360–1, 2008.
-
Kano R., Shibahashi A., Fujino Y., et al. Two cases of feline orbital aspergillosis due to A. udagawae and A. virdinutans. J Vet Med Sci, 75: 7–10, 2013.
-
Davies C., Troy G. C. Deep mycotic infections in cats. J Am Anim Hosp Assoc, 32(5): 380–91, 1996.
-
Vogler G. A., Wagner J. E. What’s your diagnosis. Lab Anim, 5: 14, 1975.
-
Barrs V. R., Halliday C., Martin P., et al. Sinonasal and sino-orbital aspergillosis in 23 cats: aetiology, clinicopathological features and treatment outcomes. Vet J, 191(1): 58–64, 2012.
-
Peeters D., Clercx C. Update on canine sinonasal aspergillosis. Vet Clin North Am Small Anim Pract, 37(5): 901–16, 2007.
-
Wilkinson G. T., Sutton R. H., Grono L. R. Aspergillus spp infection associated with orbital cellulitis and sinusitis in a cat. J Small Anim Pract, 23(3): 127–31, 1982.
-
Goodall S. A., Lane J. G., Warnock D. W. The diagnosis and treatment of a case of nasal aspergillosis in a cat. J Small Anim Pract, 25(10): 627–33, 1984.
-
Hamilton H. L., Whitley R. D., McLaughlin S. A. Exophthalmos secondary to aspergillosis in a cat. J Am Anim Hosp Assoc, 36(4): 343–7, 2000.
-
Tomsa K., Glaus T. A., Zimmer C., et al. Fungal rhinitis and sinusitis in three cats. J Am Vet Med Assoc, 222(10): 1380–4, 2003.
-
Malik R., Vogelnest L., O’Brien C. R., et al. Infections and some other conditions affecting the skin and subcutis of the naso-ocular region of cats: clinical experience 1987–2003. J Feline Med Surg, 6(6): 383–90, 2004.
-
Karnik K., Reichle J. K., Fischetti A. J., et al. Computed tomographic findings of fungal rhinitis and sinusitis in cats. Vet Radiol Ultrasound, 50(1): 65–8, 2009.
-
Furrow E., Groman R. P. Intranasal infusion of clotrimazole for the treatment of nasal aspergillosis in two cats. J Am Vet Med Assoc, 235(10): 1188–93, 2009.
-
Barachetti L., Mortellaro C. M., Di Giancamillo M., et al. Bilateral orbital and nasal aspergillosis in a cat. Vet Ophthalmol, 12(3): 176–82, 2009.
-
Giordano C., Gianella P., Bo S., et al. Invasive mould infections of the naso-orbital region of cats: a case involving Aspergillus fumigatus and an aetiological review. J Feline Med Surg, 12(9): 714–23, 2010.
-
Smith L. N., Hoffman S. B. A case series of unilateral orbital aspergillosis in three cats and treatment with voriconazole. Vet Ophthalmol, 13(3): 190–203, 2010.
-
Fox J. G., Murphy J. C., Shalev M. Systemic fungal infections in cats. J Am Vet Med Assoc, 173(9): 1191–5, 1978.
-
Ko ̈hler H., Kuttin E., Kaplan W., et al. Occurence of systemic mycoses in animals in Austria. Zentralbl Veterinarmed B, 25(10): 785–99, 1978.
-
Ossent P. Systemic aspergillosis and mucormycosis in 23 cats. Vet Rec, 120(14): 330–3, 1987.
-
Donald C. Plumb. Plumb’s Veterinary Drug Handbook sixth edition, Pharm D, 2008.
-
Erik R. Wisner, Allison L. Zwingenberger. Atlas of small animal CT and MRI, 2015.
-
Patrick R. Gavin, Rodney S. Bagley. Practical small animal MRI, 2009.
-
Tumors in domestic animals. Edited by Donald J. Meuten. Description. Fifth edition. Ames, Iowa: John Wiley & Sons Inc., 2017.





 vetpeterburg
vetpeterburg Ветеринарный Петербург
Ветеринарный Петербург