Giuseppe Moniello2, Pietro Lombardi1, Monica Isabella Cutrignelli1
- Department of Veterinary Medicine and Animal Production, University of Napoli Federico II, Via Federico Delpino 1, 80137 Napoli, Italy.
- Department of Veterinary Medicine of Sassari, Via Vienna 2, 07100 Sassari, Italy.
Резюме
В статье оценивалась краткосрочная и долгосрочная гликемическая реакция у здоровых кошек после применения четырех программ различных рационов. Корма каждого рациона альтернативно использовались шестью здоровыми кошками в течение 30 дней. В конце каждого периода животных взвешивали и брали образцы крови для определения концентраций глюкозы и фруктозамина. Гликемию измеряли каждые 2 часа в течение 24 часов с помощью автоматического глюкометра. Рационы с повышенным уровнем белка и низким содержанием крахмала (VHP/LS), а также с высоким содержанием белка и умеренным уровнем крахмала (HP/LS) показали существенно заниженные значения концентраций глюкозы (среднее и пиковое) и фруктозамина в отличие от диет с умеренным содержанием белка и высоким содержанием крахмала (MP/HS). Вполне вероятно, что эти результаты обусловлены влиянием следующих пищевых характеристик: уровень белка, соотношение белок/крахмал и пищевые волокна. Все эти параметры были выше у диет VHP/LS и HP/MS. Указанные предварительные результаты дают основание предполагать, что использование рационов с высоким соотношением белок/крахмал и уровнем растворимой клетчатки способствует метаболизму углеводов у здоровых кошек.Введение
За последние 30 лет распространенность ожирения и сахарного диабета у кошек увеличилась более чем на 10%, как сообщает Лутц (Lutz T. A., 2008)13, тогда как уровень смертности животных постепенно снижался с 40% до 10%, вероятно, из-за получения более глубоких знаний о патогенетических механизмах, определяющих начало развития болезни17. Диабет у кошек тесно связан с ожирением, потому что он напрямую зависит от инсулинорезистентности14. В связи с этим конкретные модификации диеты являются важными аспектами как для предотвращения развития сахарного диабета16, так и для его лечения, что делает выбор подходящей диеты для кошек, больных диабетом, одной из главных стратегий управления этим заболеванием. Основные цели данного подхода – снижение массы тела, улучшение гликемического контроля, уменьшение риска развития инсулинорезистентности и изменений липидного профиля2. В статье Хёнинг (М. Hoening M.,2012)12 указано, что происходящие изменения у кошек, аналогичны описанным у людей, которые страдают метаболическим синдромом, хотя у кошек не наблюдалось повышения риска возникновения артериальной гипертензии, заболевания артерий и инсульта.Корма для домашних животных содержат 30–60% углеводов, в частности крахмала4. У хищников перевариваемость крахмала сильно варьируется и зависит от нескольких факторов: источник получения, размер частиц, соотношение амилоза/амилопектина и процесс желатинизации. Однако собаки и кошки почти полностью переваривают крахмал21, который является основным питательным веществом, влияющим на постпрандиальную реакцию глюкозы и инсулина у этих животных6. Другими диетическими факторами, воздействующими на указанные реакции, являются соотношение белок/крахмал, пищевые волокна и профиль жирных кислот4.
Опубликовано несколько отчетов о влиянии состава рациона на гликемический ответ кошек11,16, и большинство из них посвящено кошкам, больным диабетом. Следовательно, имеется недостаточно информации о влиянии состава рациона на постпрандиальную реакцию глюкозы у здоровых взрослых кошек.
Целью данного исследования было сравнение концентраций глюкозы и фруктозамина после приема пищи у здоровых животных из семейства кошачьих с использованием различных диетических программ, разработанных для питания взрослых кошек.
Материалы и методы
В данное исследование были включены 6 кастрированных здоровых взрослых кошек [вес 4,6 ± 0,3 кг, BCS (9-бальная шкала) 5,7 ± 0,5, возраст 3,5 ± 0,2 года]. На протяжении всего экспериментального периода (30 дней по 4 программы рационов) животные продолжали жить в обычных условиях, следуя своим привычкам, за исключением назначенного рациона. Для учета принимаемой пищи хозяевам выдали специальную карточку, в которой они ежедневно указывали количество даваемого питомцам корма или отказ от его употребления.Были использованы четыре экструдированных коммерческих рациона со следующими характеристиками: очень высокий уровень белка и низкий уровень крахмала из картофеля (VHP/LS), высокий уровень белка и умеренный уровень крахмала из овса и дикой пшеницы (HP/MS) и два традиционных рациона, характеризующихся умеренным содержанием белка и высокой концентрацией крахмала из риса и кукурузы (MP/HS1 и MP/HS2). Химический состав каждого рациона определялся в соответствии с методами, представленными AOAC (англ. Association of Official Analytical Chemist, 2006), а фракции пищевых волокон – согласно методике, предложенной Проски с соавторами (Prosky et al.18,19). Плотность энергии (ккал ME/кг) оценивалась по химическим параметрам.
Все диетические программы альтернативно использовались (100 ккал ME/кг0,67/день) в течение 30 дней (10 адаптаций + 20 испытаний) в соответствии с рандомизированным планом 6×4. В конце каждого периода кошек не кормили в течение ночи, их взвешивали и устанавливали катетер для сбора образцов крови. Концентрацию фруктозамина в сыворотке определяли с использованием набора (код 90009660, Seac Radim Company, Флоренция, Италия) и спектрофотометра (Helios Gamma, Thermo, Рочестер, Нью-Йорк, США).
Для оценки краткосрочного гликемического ответа уровень глюкозы в сыворотке измеряли каждые 2 часа в течение 24 часов (12 проб) с помощью автоматического глюкометра (Cera-Pet, Mod. G300V, Ceragem Medisis, Йонъин, Южная Корея). Во время такой оценки корма́ интересующей диеты давали в 8:00 в соотношении 50% суточной потребности (50 ккал ME/кг0,67), а после 6-й оценки другие 50 ккал ME/кг0,67 диеты скармливали в течение 30 минут, отказы (остатки корма) взвешивались, чтобы оценить потребление корма. Значения концентраций глюкозы (среднее и пиковое) и фруктозамина подверглись дисперсионному анализу (ANalysis Of VAriance; ANOVA) с использованием Proc. GLM SAS1 для оценки эффективности диеты в соответствии со следующим уравнением:
Yij = μ + αi + εij, где yi – зависимая переменная, μ – среднее значение, α – эффективность диеты (i: VHP/LS, HP/MS, MP/HS1 и MP/HS2), а ε – погрешность.
Результаты
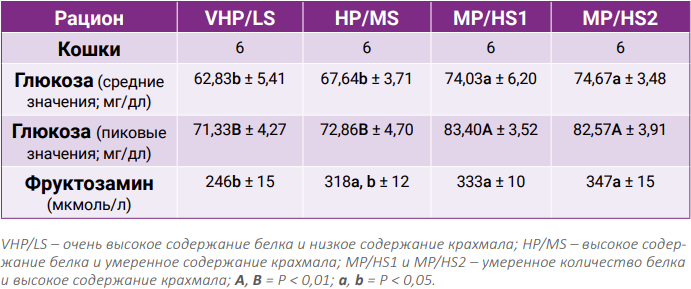
Основные питательные характеристики рационов представлены в табл. 1. Как и ожидалось, диеты VHP/LS и HP/MS показали значения сырого протеина и соотношения P/S выше, чем две другие диеты MP/HS, рассмотренные в этом исследовании. Обе диеты богатые белком характеризовались повышенным содержанием общего количества пищевых волокон, однако только диета HP/MS показала самые высокие значения растворимых пищевых волокон.Вес тела животных был приблизительно постоянным во время испытания (4,7, 4,7, 4,6 и 4,6 кг при использовании диет HP/MS, VHP/LS, MP/HS1 и MP/HS2 соответственно). Не было зарегистрировано значительных различий в употреблении кормов в период адаптации (93,76, 94,20, 92,89 и 91,78 ккал МЕ/кг0,67 при использовании рационов MP/HS1, MP/HS2, HP/MS и VHP/LS соответственно) или в течение 24 часов наблюдения (37,5, 38,11, 36,33 и 36,76 ккал ME/кг0,67 при использовании рационов MP/HS1, MP/HS2, HP/MS и VHP/LS соответственно). Однако гликемический ответ (табл. 2) показал значительные различия как средних, так и пиковых значений.
Аналогичная тенденция наблюдалась и в отношении показателей концентрации фруктозамина, хотя в этом случае наблюдались существенные различия между диетами MP/HS 1 и 2 и между рационами VHP/LS и HP/MS.
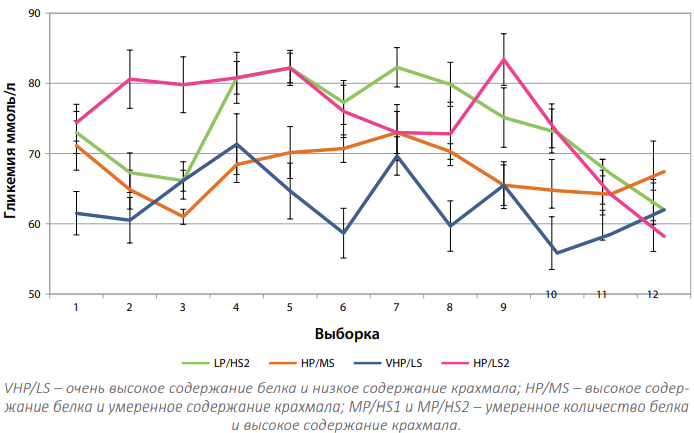
На рис. 1 показаны кривые средних значений уровня глюкозы в крови, наблюдаемые при использовании четырех рационов. Более сильные колебания гликемических значений были связаны с рационами, имеющими самое низкое соотношение P/S.
Обсуждение
В данном исследовании гликемический ответ, полученный путем применения четырех рационов, оценивался и сравнивался у здоровых кошек, чтобы понять влияние химического состава коммерческих рационов на некоторые характеристики углеводного обмена у этих животных. Даже если все зарегистрированные уровни гликемии и фруктозамина были в пределах нормы, использование диет VHP/LS и HP/MS показывало самые низкие пиковые и средние гликемические значения. Эти предварительные результаты дают основание предполагать, что ингредиенты и химический состав кормов влияют на некоторые особенности углеводного обмена у кошек. Действительно, предыдущие исследования продемонстрировали, что диета с высоким содержанием белка может снизить прибавку в весе и уровень глюкозы после приема пищи, тем самым улучшая общий контроль глюкозы у людей9,10 и у кошек8, страдающих сахарным диабетом 2-го типа. В научном сообществе ведутся споры о влиянии высокобелковой диеты на выработку инсулина. В некоторых опубликованных работах сообщается о повышенном уровне инсулина23, в то время как в других исследованиях этот факт не подтверждается10,20.По нашему мнению, долгосрочное назначение здоровым кошкам высокоэнергетических диет, в основном состоящих из легкоусвояемых углеводов, приводит к высокому постпрандиальному уровню гликемии и увеличению концентрации фруктозамина, тогда как применение диет, характеризующихся аналогичной энергетической плотностью, но с более высоким уровнем белка, может способствовать уменьшению концентраций глюкозы и фруктозамина. Снижение постпрандиальных уровней гликемии и показателей фруктозамина также было связано с высокой концентрацией растворимых пищевых волокон в диетах VHP/LS и HP/MS. Действительно, как отмечалось в работе Мори с соавторами (Mori et al.)16, пищевые волокна, которые не перевариваются, но ферментируются в толстой кишке плотоядных животных3, способствуют снижению абсорбции глюкозы и потребности в инсулине. Даже если механизмы до сих пор неизвестны, растворимые пищевые волокна, по-видимому, влияют на скорость переноса питательных веществ в кишечник, тем самым снижая абсорбцию глюкозы после приема пищи и, следовательно, улучшая гликемический контроль5,7. Однако при употреблении обоих рационов MP/HS были зарегистрированы более высокие гликемические показатели, таким образом, можно было подтвердить гипотезу о том, что плотоядные животные и, в частности, представители семейства кошачьих, не очень хорошо приспособлены для быстрого метаболизма большого количества глюкозы в соответствии с результатами, опубликованными Миллером и Коладжури (Miller J. C., Colagiuri S., 1994)15. Даже если глюкоза и уровни фруктозамина, зарегистрированные в ходе этого исследования, постоянно находились в физиологическом диапазоне, употребление кормов с высоким содержанием белка приводило к модулированию постпрандиального гликемического ответа. Влияние на метаболизм углеводов также было подтверждено более низкими значениями концентрации фруктозамина22.
Выводы
Предварительные результаты показывают, что применение рационов с высоким содержанием белка и пищевых волокон влияет на гликемический ответ у кошек.Значения этих данных не исключают дальнейшего изучения их влияния на здоровье животных. В частности, должен быть исследован постпрандиальный инсулиновый ответ, чтобы оценить эффект применения рационов с высоким содержанием белка и низким содержанием крахмала.
Список литературы:
- Association of Official Analytical Chemist (AOAC).Official Methods of Analysis. 18th Ed. Association of Official Analytical Chemists, Inc. Arlington, Virginia, 2006.
- Bouchard G.F., Sunvold G.D. Effect of dietary carbohydrate source on postprandial plasma glucose and insulin concentration in cats. In Recent Advances in Canine and Feline Nutrition. (G.A. Reinhart and D.P. Carey, eds). Orange Frazer Press, Wilmington USA, 2000.
- Calabrò S., Carciofi A.C., Musco N., Tudisco R., Gomes M.O.S., Cutrignelli M.I. Fermentation characteristics of several carbohydrate sources for dog diets using the in vitro gas production technique. Italian Journal of Animal Science, 12, e4, 21-27, 2012.
- Carciofi A.C., Takakura F.S., de Oliveira L.D., Teshima E., Jeremias J.T., Brunetto M.A., Prada F. Effects of six carbohydrate sources on dog diet digestibility and post prandial glucose and insulin response. J Anim Physiol Anim Nutr (Berl), 92 (3), 326-336. doi: 10.1111/j.1 439 0396.2007.00794.x. 2008.
- Costacou T., Mayer Davis E.J. Nutrition and prevention of type 2 diabetes. Ann Rev Nutrition, 23, 147-170, 2003.
- de Oliveira L.D, Carciofi A.C, Oliveira M.C.C., Vasconcellos R.S., Bazolli G.T. Effects of six carbohydrate sources on diet digestibility and postprandial glucose and insulin responses in cats. J Anim Sci, 86, 2237-2246, 2008.
- Feldman E.C., Nelson R.W. Diabetes mellitus. In Canine and Feline Endocrinology and Reproduction. 3rd Ed. (W.B. Saunders, ed), Philadelphia, 486-538, 2004.
- Frank G., Anderson W., Pazak H., Hodgkins E., Ballam J., Laflamme D. Use of a high protein diet in the management of feline diabetes mellitus. Veterinary Therapies, 2 (3), 238-246, 2001.
- Gannon M.C. & Nuttall F.Q. Effect of a high protein, low carbohydrate diet on blood glucose control in people with type 2 diabetes. Diabetes, 53, 2375-2382, 2004.
- Gannon M.C., Nuttall F.Q., Saeed A., Jordan K., Hoover H. An increase in dietary protein improves the blood glucose response in persons with type 2 diabetes. Am J Clin Nutrition, 78, 734-741, 2003.
- Hoening M., Thomaset K., Waldrom M., Ferguson D.C. Insulin sensitivity, fat distribution, and adipocytokine response to different diets in lean and obese cats before and after weight loss. Am J Physiol Regul Integr Comp Physiol, 292, R227 - R234, 2007.
- Hoening M. The cat as a model for human obesity and diabetes. J Diabetes Sci Technol, 6, 525-533, 2012.
- Lutz T.A. Feline diabetes Mellitus: Nutritional strategies In Encyclopedia os feline clinical Nutrition (P. Pibot, V. Biourge & D. Elliott, eds). Aniwa SAS on behalf of Royal Canin, 182-217, 2008.
- Lutz T.A., Rand J.S. Pathogenesis of feline diabetes mellitus. Vet Clin North Am Small Anim Pract, 25, 527-552, 1995.
- Miller J.C., Colagiuri S. The carnivore connection: dietary carbohydrate in the evolution of NIDDM. Diabetologia, 37, 1280-1286, 1994.
- Mori A., Sako T., Lee P., Nishimaki Y., Fukuta H., Mizutani H., Honjo T., Arai T. Comparison of three commercially available prescription diet regimens on short term post prandial serum glucose and insulin concentrations in healthy cats. Vet Res Commun, 33, 669-680, 2009.
- Prahl A., Guptill L., Glickman N.W., Tetrick M., Glickman L.T. Time trends and risk factors for diabetes mellitus in cats presented to veterinary teaching hospitals. J Feline Med Surg, 9, 351-358, 2007.
- Prosky L., Asp N.G., Furda I., DeVires J.W., Schweizer T.F., Harland B.F. Determination of total dietary fibre in food and food products: collaborative study. J Assoc Off Anal Chem, 68, 677-679, 1985.
- Prosky L., Asp N.G., Schweizer T.F., DeVires J.W., Furda I. Determination of insoluble and soluble dietary fibre in food and food products: collaborative study. J Assoc Off Anal Chem, 75, 360-367, 1992.
- Sargrad K.R., Homko C., Mozzoli M., Boden G., Perry M.L. Effect of high protein vs highcarbohydrate intake on insulin sensitivity, body weight, hemoglobin Alc, and blood pressure in patients with Type 2 diabetes mellitus. J Am Diet Assoc, 105, 573-582, 2005.
- Svihus B., Uhlen A.K., Harstad O.M. Effect of starch granule structure, associated components and processing on nutritive value of cereal starch: a review. Anim Feed Sci Tech, 122, 303-320, 2005.
- Thiess S., Becskei C., Tomsa K., Lutz T.A., Wanner, M. Effects of high carbohydrate and high fat diet on plasma metabolite levels and on i.v. glucose tolerance test in intact and neutered male cats. J Feline Med Surg, 6, 207-218, 2004.
- Usami M., Seino Y., Seino S., Takemura J., Nakahara H., Ikeda M., Imura H. Effects of high protein diet on insulin and glucagon secretion in normal rats. J Nutr, 112 (4), 681-685, 1982.


 vetpeterburg
vetpeterburg Ветеринарный Петербург
Ветеринарный Петербург